

输液医疗设备出口美国FDA应急EUA方案
4月11日,为有效应对公众突发卫生事件和COVID-19病毒的防治工作,美国FDA 针对输液泵及其附件发布执行政策(Enforcement Policy for Infusion Pumps and Accessories During the Coronavirus Disease 2019 (COVID-19) Public Health Emergency)。详情如下:
此前,FDA已紧急使用授权(EUA)中国标准的口罩企业名单,授权企业链接为(名单动态更新):
https://www.fda.gov/media/136663/download
一、覆盖产品及范围
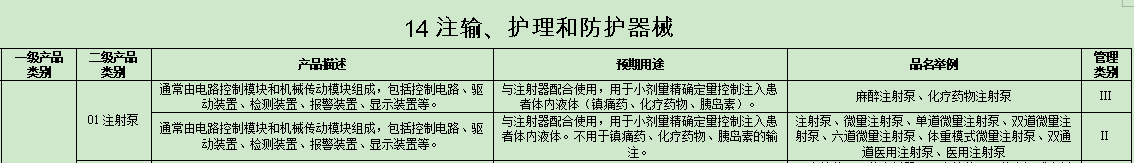
输液泵 Infusion Pump(FRN)
患者自控镇痛输液泵 Patient-controlled analgesia (PCA) Infusion Pump (MEA)
输液泵配件 Infusion Pump Accessories (MRZ)
输液安全管理软件 Infusion Safety Management Software (PHC)等
二、EUA具体实施方案
以下方案分别从产品未获得FDA批准和已获得FDA批准两种情况来解读。
A、输液设备制造商未获得FDA批准:
1、 符合QSR820或者ISO13485体系,做好体系文件准备;需美国授权代表。
2、 本国营销授权(如:中国医疗器械注册证等)。
注意:
特别指出,开关电源、适配器及插脚的选用符合美标要求。
B、输液设备制造商已获得FDA批准:
1、 考虑到疫情期间主要元器件厂家(电机、输液泵配件)的供应链中断风险,输液泵允许更换部件,但需要做好主记录备查。
2、 对硬件、软件产品可进行有限的修改,产品的设计或材料,无须事先提交上市前通知。
3、 为更大力度保护医护人员与病患的接触,可新增无线功能控制,除FCC外,需评估网络安全及射频安全。
4、 对设备硬件、软件、设计、材料或使用期限所做的更改后,需按更改和增加项,执行标准安全方面的对应评估;
对应的ISO14971风险管理和软件IEC 62304需同步修订。
5、 已更改的产品在标示上应明确说明该产品未获得FDA批准或许可。
注意:
以上更改,制造商必须记录在其设备主记录和更改控制记录中,并将此信息提供给FDA。
三、产品检测标准
IEC 60601-1:2005/A1:2012+ES
IEC60601-1-2:2014
IEC60601-1-8:2006+A1:2012
IEC60601-2-24:2012
IEC60601-1-11:2015
IEC60601-1-12(急救)
输液管路等附件生物学:ISO10993
无线共存:AAMI TIR69: 2017/ANSI/IEEE C63.27
四、产品检测资料准备
1、产品说明书(手册)
2、ISO14971风险管理报告 风险管理计划 风险管理程序
3、IEC62304软件管理报告
4、电路原理图
5、铭牌(英文版)
6、关键元器件清单表
7、检测申请表
8、定频指引(针对无线功能)
https://www.fda.gov/medical-devices/emergency-situations-medical-devices/emergency-use-authorizations#covid19ventilators
如您有相关办理需求,欢迎您直接来电咨询我司工作人员,获得详细的费用报价与周期等信息。
恩湛咨询竭诚为您服务!电话:400-880-6978
来源:网络收集整理